一、团队介绍:
565net必赢最新版医药前沿技术研究院药理学研究团队组建于2021年。团队成员包括教授1人、讲师3人,以及在读研究生数人。通过药理学与生物信息学、病理生理学、生物化学和生物制药等多学科联合攻关,团队总体定位是围绕心血管系统疾病及恶性肿瘤发生发展中的重点、难点问题,开展疾病发病机制、药物作用新靶点及创新防治药物研发工作,以改善防治水平,促进医药领域的发展。团队研究方向包括心血管系统疾病(心肌肥厚、心肌缺血再灌注损伤、心律失常等)的发病机制研究、药物作用靶点机制研究、肿瘤药理学及非编码RNA成药性等研究。团队成员都曾主持或参加国家重点基础研究发展计划(973计划);国家自然科学基金面上项目等项目,目前承担上海市心脑血管非编码RNA成药性前沿科学研究基地(培育)建设;并在Circulation、J Clin Invest、Cardiovascular Research等国际知名杂志发表高水平科研论文。
研究方向1:心血管系统疾病的发病机制研究
将生物信息技术、人工智能大数据及生物学技术相结合,深入解析心血管系统疾病的分子网络机制,发现新型干预靶点,突破心血管疾病的药物研发瓶颈,有利于提高心脑血管系统疾病的整体防治水平。团队系列研究表明微小核苷酸(miRNA)对心脏结构重构以及电重构过程具有重要调控作用。包括miR-26a、miR-101,miR-1,miR 328,let-7d等micro RNA在小鼠房颤、传导阻滞、心肌纤维化、心肌肥厚等病理过程中的作用,证明了micro RNA 可能作为心脏疾病治疗的候选RNA分子。近期研究发现长链非编码RNA对压力应激引起的心肌肥厚具有重要调控作用。包括LncRNA KCND1、Ak084656、Gm20257在小鼠心肌肥厚的病理过程中发挥重要作用,揭示了其作用机制和下游靶点,揭示了其作用机制和下游靶点,为药物作用机制研究开辟新的思路、新的药物作用靶点的发现。
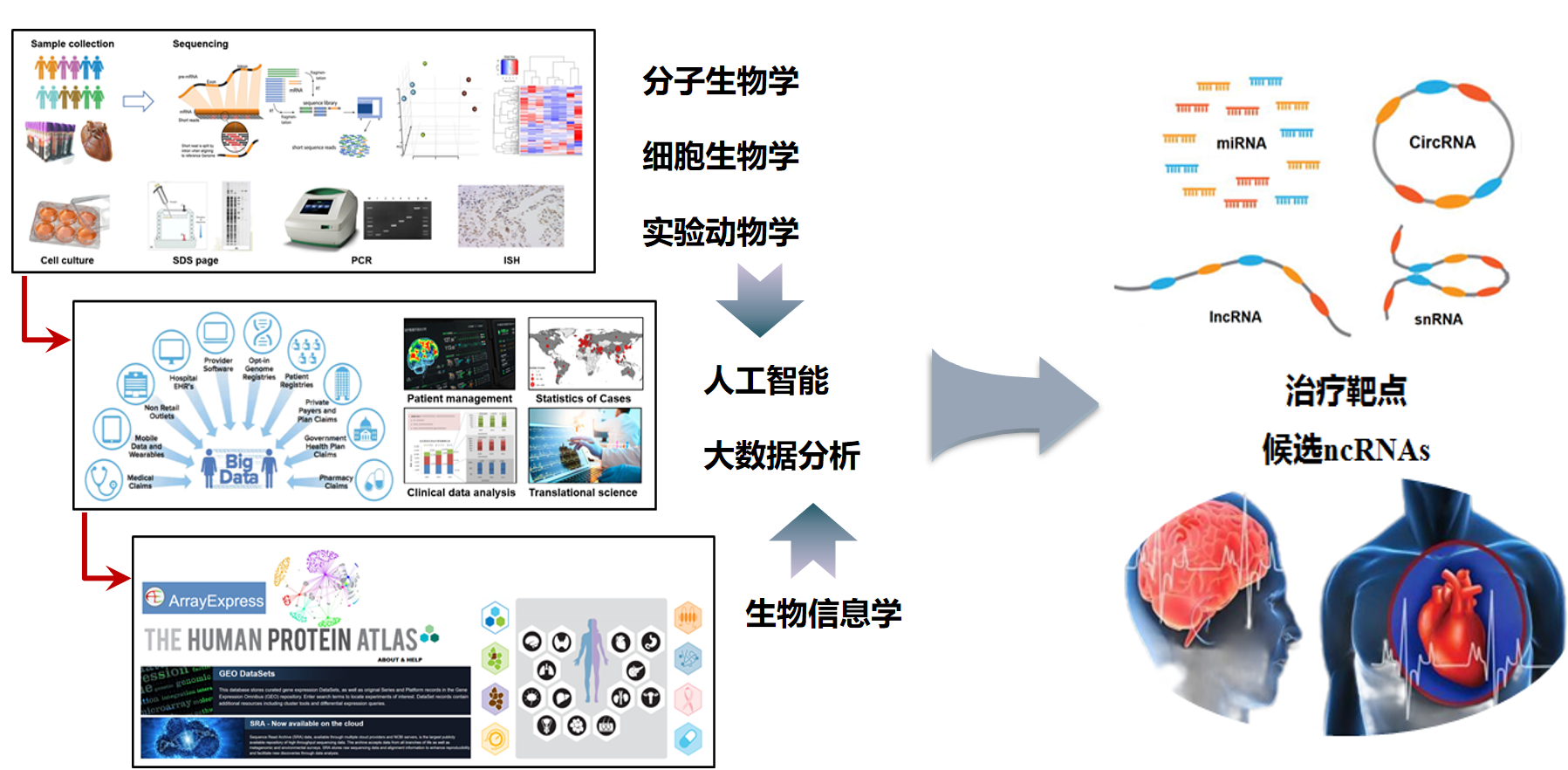
研究方向2:药物作用靶点的机制研究
探索心肌肥厚、心肌缺血再灌注损伤、心律失常等心脏重大疾病的药物作用靶点,发现NAP1l1、NET1、SerpinE2、ITFG2等潜在靶点,揭示以上靶点在心脏损伤调控过程中的分子机制;基于分子对接分子动力学模拟、热力学积分、自由能计算研究小分子与潜在作用靶点的相互作用,为药物开发提供新思路。
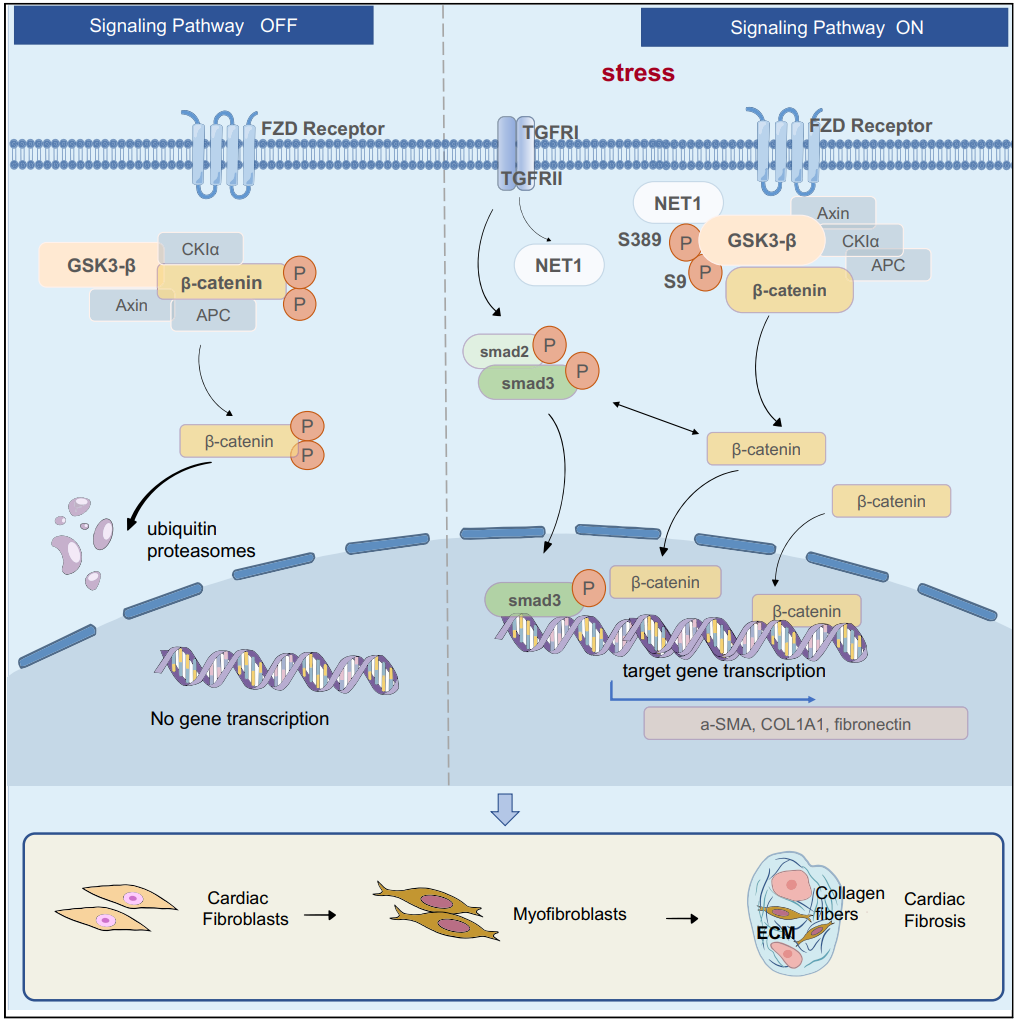
研究方向3:肿瘤药理学
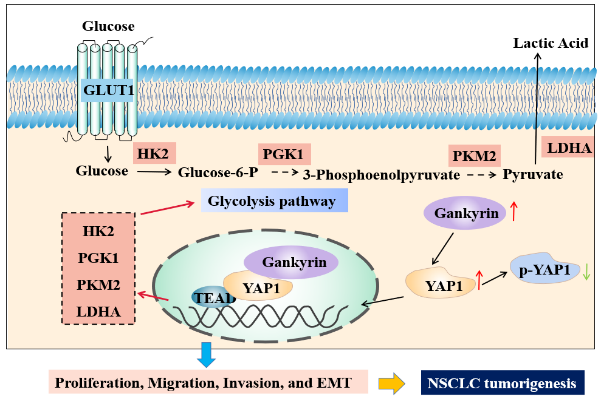
探索在非小细胞肺癌、卵巢癌等恶性肿瘤进展中起关键作用的药物作用靶点,发现YAP1、长链非编码RNA PTAL等潜在靶点,并揭示其作用机制;利用生物医药虚拟筛选与智能平台,筛选潜在靶向肿瘤的药物分子,进行抗肿瘤药效评价及作用机制研究,为新型抗肿瘤药物研发提供新靶点。
研究方向4:非编码RNA成药性研究
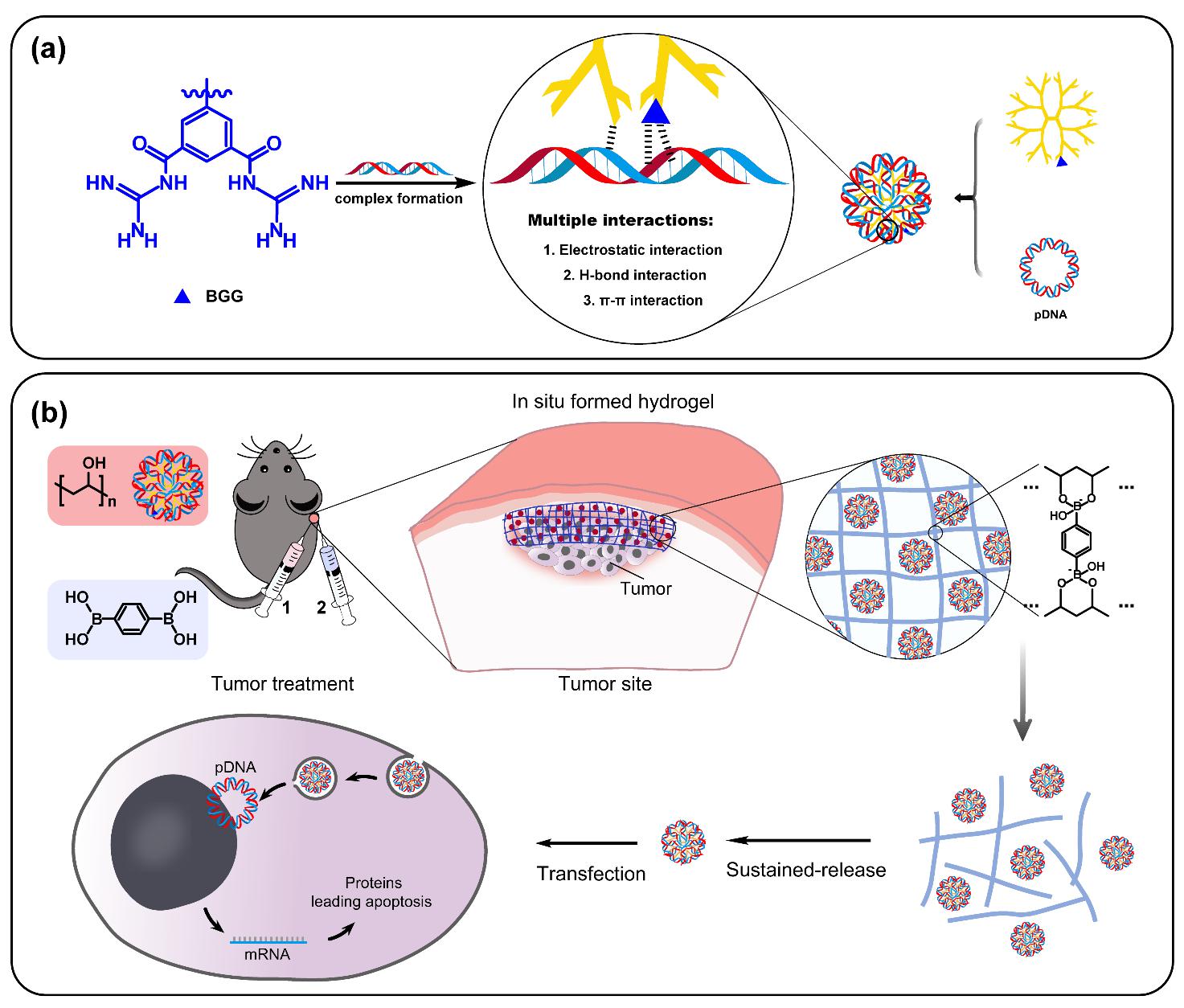
结合已经有的实验研究、整合公开数据库资源,利用人工智能预测筛选高效治疗心血管疾病、肺纤维化、肿瘤等重大疾病的非编码RNA,对非编码RNA药效、药理及毒理学进行评价;利用病灶部位特殊的微环境因子、受体与配体高亲和性以及递送材料与外部信号之间的主客效应,构建系列智能药物递送系统,为非编码RNA药物的开发提供理论支撑。
研究方向5:生物医学智能检测和医用机器人、医疗器械
我国《“十四五”医疗装备产业发展规划》中明确指出:推进智能化、远程化、小型化、快速化、精准化、多模态融合、诊疗一体化发展,是我国当前医疗装备发展的一个重要方向;支持医疗装备、医疗机构、电子信息、互联网等跨领域、跨行业深度合作,鼓励医疗装备集成5G医疗行业模组,嵌入人工智能、工业互联网、云计算等新技术,推动医疗装备智能化、精准化、网络化发展,是目前前沿医疗装备、医疗仪器开发的有力的政策支撑。该研究方向聚焦于生物传感器研究、生物医学智能检测、可穿戴超声等医用装备和机器人开发、医疗图像处理、医用机器人智能控制等。
二、团队成员:
1 |
| 单宏丽:女,二级教授,博士, 中国协和医科大学 药理学专业 Email: shanhl@sues.edu.cn 主要从事心血管疾病发病机制、防治及药物靶点的研究,重点致力于探索微小核苷酸对心脏生理及病理过程的调控机制,并基于此寻找重大心血管疾病新的药物治疗靶点。尤其是近几年,系统阐释了非编码RNA(Non-coding RNAs,ncRNAs)在心肌电重构和结构重构中的作用机制,评价了ncRNAs作为心血管疾病治疗策略的可行性。主持完成973、国家自然科学基金等课题10余项,共发表研究论文110余篇,其中在Circulation、J Clin Invest、Cardiovascular Research等国际知名杂志发表SCI收录论文70余篇。获教育部科技进步一等奖及其他省部级奖项八项。 |
2 |
| 于桐:女,讲师,博士, 哈尔滨医科大学 药理学专业 Email: yutongyt@sues.edu.cn 主要从事非编码RNA在心脏损伤和肿瘤疾病中的机制研究,致力于寻找新的干预靶点和治疗药物,在MedComm、Cell Death and Discovery、British Journal of Cancer、FASEB J等杂志上累计发表科研论文15篇。参与国家自然科学基金重点项目1项,面上项目1项,上海市基地建设项目1项。 |
3 |
| 蒋淑侠:女,讲师,博士 南京农业大学,动物医学专业 主要从事非编码RNA和小分子化合物在肺纤维化和肿瘤疾病中的机制研究,在国际学术期刊累计发表科研论文8篇,其中第一作者发表SCI收录文章4篇。 |
4 |
| 丁大民:男,讲师,博士 上海理工大学 控制科学与工程专业 Email: dingdm@sues.edu.cn 主要研究方向纵向为生物传感器研究、可穿戴超声等医用装备和机器人开发、医疗图像处理、ADRC自抗扰控制等;横向主要从事医疗器械开发、光电智能仪器设计及制造、电气智能检测设备开发、数字信号分析与处理、模式识别系统开发等,在电路设计、单片机及DSP开发、PLC控制、LabVIEW编程等领域具有丰富的产品设计和设备开发经验。近年来先后在Nuclear Engineering and Technology等国际学术期刊上发表SCI论文4篇,国家专利授权1项。参与国家重点研发计划项目1项、国自然面上项目1项,上海市科委科技支撑项目和科技创新行动计划2项。 |
三、研究成果:
Neuroepithelial cell-transforming 1 promotes cardiac fibrosis via the Wnt/β-catenin signaling pathway. iScience, 26(10), 107888. doi:10.1016/j.isci.2023.107888
Nucleosome assembly protein 1 like 1 (NAP1L1) promotes cardiac fibrosis by inhibiting YAP1 ubiquitination and degradation. MedComm (2020), 2023 Aug 15;4(5):e348. doi: 10.1002/mco2.348. PMID: 37593048; PMCID: PMC10427634.
Substrate-dependent interaction of SPOP and RACK1 aggravates cardiac fibrosis following myocardial infarction. Cell Chem Biol. 2023 Jun 27:S2451-9456(23)00192-7. doi: 10.1016/j.chembiol.2023.06.015.
Long non-coding RNA KCND1 protects hearts from hypertrophy by targeting YBX1. Cell Death Dis. 2023 May 30;14(5):344. doi: 10.1038/s41419-023-05852-7.
Interdependent Nuclear Co-Trafficking of ASPP1 and p53 Aggravates Cardiac Ischemia/Reperfusion Injury. Circ Res. 2023 Jan 20;132(2):208-222. doi: 10.1161/CIRCRESAHA.122.321153.
Endocytosis of Peptidase Inhibitor SerpinE2 promotes Myocardial Fibrosis through activating ERK1/2 and β-catenin Signaling Pathways.International Journal of Biological Sciences.2022; 18(15): 6008-6019. doi: 10.7150/ijbs.67726.
Critical role of PAFR/YAP1 positive feedback loop in cardiac fibrosis. Acta Pharmacol Sin. 2022 Nov;43(11):2862-2872. doi: 10.1038/s41401-022-00903-9.PMID: 35396533.
LncRNA DACH1 protects against pulmonary fibrosis by binding to SRSF1 to suppress CTNNB1 accumulation. Acta Pharm Sin B. 2022 Sep;12(9):3602-3617. doi: 10.1016/j.apsb.2022.04.006.
Montelukast, cysteinyl leukotriene receptor 1 antagonist, inhibits cardiac fibrosis by activating APJ. Eur J Pharmacol. 2022 May 15;923:174892. doi: 10.1016/j.ejphar.2022.174892.
The Facile Preparation of PBA-GO-CuO-Modified Electrochemical Biosensor Used for the Measurement of α-Amylase Inhibitors' Activity. Molecules. 2022 Apr 7;27(8):2395. doi: 10.3390/molecules27082395.
Construction of ultrasound-responsive urokinase precise controlled-release nanoliposome applied for thrombolysis. Front Bioeng Biotechnol. 2022 Aug 9;10:923365. doi: 10.3389/fbioe.2022.923365.
Gankyrin modulated non-small cell lung cancer progression via glycolysis metabolism in a YAP1-dependent manner. Cell Death Discov, 8(1), 312. doi:10.1038/s41420-022-01104-3
Cytoplasmic sequestration of p53 by lncRNA-CIRPIL alleviates myocardial ischemia/reperfusion injury. Commun Biol, 5(1), 716. doi:10.1038/s42003-022-03651-y
科研项目
1.上海市心脑血管非编码RNA成药性前沿科学研究基地(培育)。
2.国家自然科学基金面上项目,NAP1L1调控Hippo/YAP1通路参与心肌纤维化的机制研究。
3.黑龙江省自然科学基金重点,心肌梗死的新机制:A lncRNA 对溶酶体- - 线粒体网络的调控作用。
4.国家自然科学基金面上项目,线粒体自噬新的调控分子:lncRNAs及其生物网络构建。
5.国家自然科学基金应急管理项,长链非编码RNA参与心肌自噬的发生及其机制研究。
6.黑龙江省杰出青年科学基金项,微小核苷酸分子在重大心脏疾病中调控机制。
7.国家重点基础研究发展计划(973项目),心肌细胞内物流系统的表观遗传学调控。
四、仪器设备:
多功能成像仪 | 小动物活体成像系统 | 实时荧光定量PCR仪 |
双色红外激光成像系统 | 流式细胞仪 | 荧光显微镜 |
组织破碎仪 | 扫描电子显微镜 | 百万分之一天平 |
全功能酶标仪 | 超纯水系统 |




